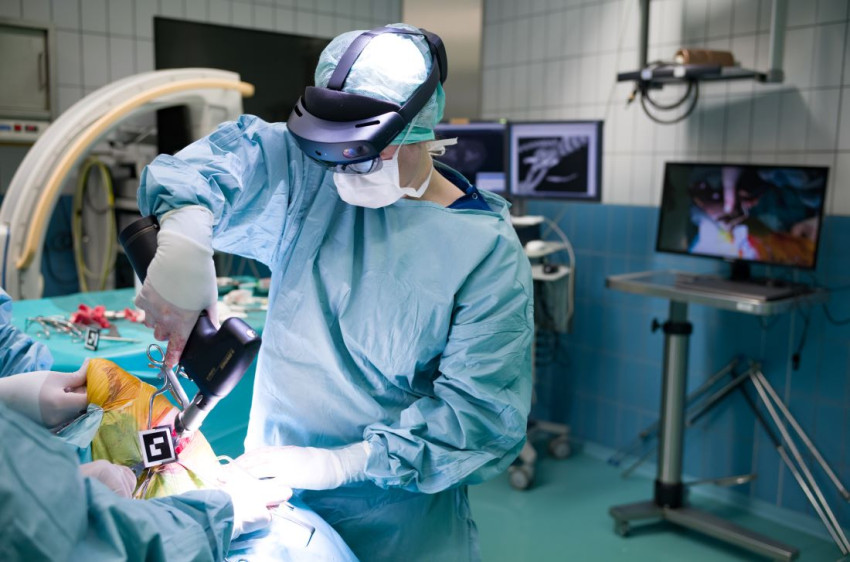
Diagnose binnen anderhalf uur dankzij snelle DNA-analyse hersentumor
Als een chirurg bij een patiënt een hersentumor weghaalt, is vaak pas na twee weken duidelijk wat voor soort tumor het was. Die diagnose kan veel sneller, laten Nederlandse wetenschappers zien met een razendsnelle DNA-analyse en kunstmatige intelligentie. Al tijdens de operatie krijgt de chirurg de informatie en kan zij de snijstrategie er op aanpassen.
Een primaire tumor in de hersenen of het ruggenmerg is een heftige diagnose die jaarlijks in ons land bij zo’n 1400 volwassenen en 150 kinderen wordt gesteld (uitzaaiingen vallen hier niet onder). Vaak besluiten de artsen om de kankercellen weg te snijden, een ingrijpende operatie die uren kan duren. Zo goed mogelijk verwijderen van de tumor – en tegelijk het gezonde weefsel zoveel mogelijk intact laten – is pas stap één in de behandeling.
De behandelend artsen willen heel graag weten wat voor soort tumor het is, want dat bepaalt het behandelplan. Daarvoor neemt de chirurg een stukje tumorweefsel en stuurt dat naar de afdeling pathologie. Daar maakt de patholoog van het weefsel een flinterdun plakje dat speciaal wordt gekleurd. Onder de microscoop kan de patholoog vaak zien wat de aard is van de tumor en die informatie gaat snel terug naar de chirurg.
Maar dit werkt nog niet ideaal, vertelt bio-informaticus Jeroen de Ridder van het UMC Utrecht. ‘Dit leidt lang niet altijd tot een diagnose, geeft vaak een niet zo heel specifieke diagnose en geeft soms zelfs de foute diagnose.’
Preciezer en behoorlijk accuraat is een DNA-gebaseerde analyse op basis van micro-arrays, maar die duurt twee weken. Niet op tijd om de chirurg mee te informeren dus.
Anderhalf uur
Dat kan sneller, zo laten artsen en onderzoekers van het UMC Utrecht, het Prinses Máxima Centrum voor kinderoncologie en Amsterdam UMC zien in een gezamenlijk project. Ze hebben een manier ontwikkeld waarbij het DNA van het tumorweefsel dat de chirurg verwijdert binnen anderhalf uur wordt geanalyseerd. Met de uitslag kan de chirurg indien nodig nog tijdens dezelfde operatie het operatieplan aanpassen.
Vermoedelijk leidt dit tot betere resultaten voor de patiënt, bijvoorbeeld doordat een tweede operatie later niet meer nodig is. De details van hun aanpak en de eerste resultaten beschreef het onderzoeksteam in een artikel in het wetenschappelijke tijdschrift Nature (open access), dat vorige week verscheen.
Combinatie van twee technologieën
De enorme tijdwinst is te danken aan een combinatie van twee relatief nieuwe technologieën: nanopore sequencing en deep learning. Nanopore sequencing is een techniek om DNA te analyseren door de lange streng DNA door een minuscuul gaatje te trekken. Daarbij neemt een elektrische spanning een bepaalde waarde aan, afhankelijk van de base – de bouwsteen van DNA – die op dat moment door het gaatje beweegt. Het Britse Oxford Nanopore is het bedrijf dat hiermee vooroploopt, en het Nederlandse team maakte dan ook gebruik van de apparaten van het bedrijf, van het type MinION.

Bijna direct resultaat
‘Bij traditionele DNA-analyse moet je soms dagen wachten op het resultaat, maar het toffe van de nanopore-methode is dat er bijna direct resultaat komt. De veranderingen in het elektrische stroompje worden meteen vertaald in een DNA-volgorde’, legt De Ridder uit.
Om precies te zijn, zoeken De Ridder en collega’s naar methylatie van het tumor-DNA, kleine aanpassingen aan het DNA die informatie prijsgeven over de aard van de tumor.
Steekproef
En hier komt de tweede onmisbare techniek om de hoek kijken: deep learning. Want hoewel het MinION-apparaatje snel is, kan het slechts een zeer beperkt deel van het tumor-DNA in kaart brengen in de beperkte tijd van een operatie. De onderzoekers moesten dus een soort steekproef van het DNA nemen en daaruit tóch de juiste conclusie trekken.
Plaatje van een dier
‘Daarvoor hebben we zelf een model opgesteld dat op basis van beperkte data betrouwbaar kan voorspellen om welk type tumor het gaat’, zegt De Ridder. ‘Vergelijk het met een plaatje van een dier waarvan je maar enkele pixels kunt zien. Bij een bepaald aantal pixels zal het menselijk brein toch herkennen of het een kat of een hond is. Dit doen wij ook, maar dan met willekeurige fragmenten van het DNA van de tumor.’
Snel terug
De informatie van de DNA-analyse gaat snel terug naar de patholoog, die deze voorspelling naast zijn eigen bevindingen op basis van het microscopiebeeld legt om tot een diagnose te komen. Die krijgt de chirurg te horen, en daarmee kan die besluiten om toch extra weefsel aan de randen van de tumor weg te snijden of juist aan de voorzichtige kant te blijven.

Voorbeeld
Een treffend praktijkvoorbeeld staat in een persbericht van het UMC Utrecht. Eelco Hoving, kinderneurochirurg en clinical director neuro-oncologie in het Prinses Máxima Centrum voor kinderoncologie: ‘Tijdens de operatie wordt soms bewust een klein restant tumorweefsel achtergelaten om neurologische schade te voorkomen. Maar als later bijvoorbeeld blijkt dat het om een zeer agressieve tumor gaat, is wellicht alsnog een tweede operatie nodig om dat laatste restje weg te halen. Dat levert dan opnieuw risico’s en spanning voor de patiënt en het hele gezin op. Dat wordt voorkomen doordat we al tijdens de eerste operatie weten met welk type tumor we te maken hebben.’
Inzetbaar bij andere tumoren?
De nieuwe aanpak van hersentumoren is misschien ook in te zetten bij tumoren elders in het lichaam, denkt De Ridder. ‘Zolang die lokale methylatie van het DNA een voorspeller is voor verschillende subtypen tumoren, is deze aanpak vermoedelijk te gebruiken. Zo trainen we ons deep learning-model momenteel met data van wekedelentumoren, ofwel sarcomen.’ Dat zijn tumoren in de weke delen, zoals spieren, pezen, zenuwen, vet, bloedvaten en lymfevaten.
‘Die extreme spoed van een operatie aan het brein is er hierbij niet, maar voor de patiënt is een wachttijd van twee weken op de uitslag van de patholoog hoe dan ook erg lang. Dat geeft onrust.’ Hoe eerder de aard van de tumor bekend is, hoe beter.
Meer weten? In deze video vertelt Jeroen de Ridder over dit onderzoek:
Openingsfoto: In een lab van het UMC Utrecht druppelt onderzoeker Carlo Vermeulen een DNA-sample op de MinION, het apparaatje dat het tumor-DNA uitleest .