
Crispr-cas laat ziektekiemen oplichten
Een Nederlands onderzoeksteam ontwikkelde een snelle test om ziektekiemen zoals het coronavirus in patiëntmonsters te detecteren. Bij aanwezigheid van het virus licht het monster blauw op.
Hoewel de coronateststraten van de GGD net allemaal zijn gesloten, is het virus dat covid-19 veroorzaakt niet verdwenen. Op dit moment worden de meeste mensen er niet meer erg ziek van, maar de kans blijft aanwezig dat er ooit weer een opleving komt van een ernstiger variant.
Bovendien wordt al jaren gewaarschuwd voor andere virussen, die een nieuwe epidemie kunnen veroorzaken. Dan zou het fijn zijn om een test te hebben die even betrouwbaar is als de PCR-test waarmee de besmetting in het lab wordt vastgesteld, maar waarbij je geen 12 tot 24 uur op de uitslag hoeft te wachten.
Zo’n test ontwikkelden onderzoekers van de TU Eindhoven, het Rijnstate Ziekenhuis in Arnhem en de Fontys Hogeschool Eindhoven. Zij verzonnen een techniek waarbij een proefmonster met ziektekiemen blauw oplicht – een glow-in-the-dark-test, noemen ze het in een nieuwsbericht van de TU/e.
De methode is succesvol getest op covid-19-patiëntmonsters, maar de techniek is ook voor andere virus- of bacterie-infecties inzetbaar.
Vorige week, op 15 maart, publiceerden de onderzoekers hun bevindingen in het wetenschappelijke tijdschrift ACS Central Science, van de American Chemical Society.
Methode
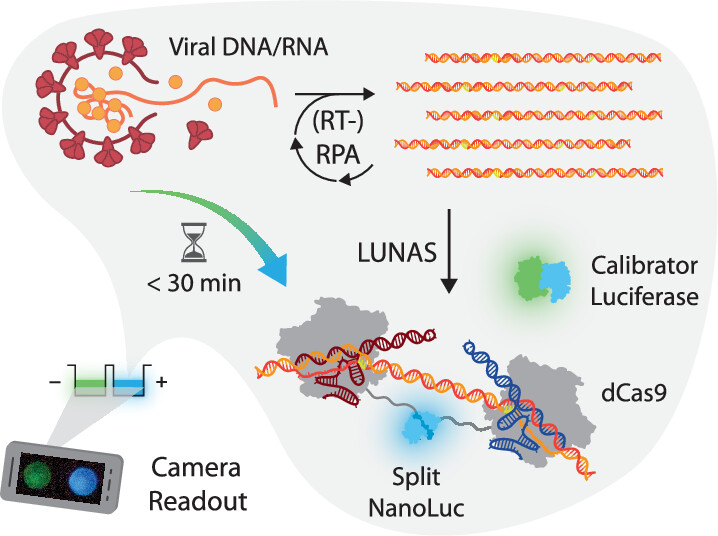
Om het oplichten voor elkaar te krijgen, maakten de onderzoekers gebruik van Crispr-cas9-eiwitten, geprogrammeerd om het genetische materiaal van virussen te herkennen. Crispr-cas is vooral bekend als gereedschap voor genetische modificatie, het cas9-eiwit is dan de schaar waarmee het knutselwerk aan de genen wordt uitgevoerd. Maar het kan ook voor andere doeleinden worden gebruikt, zoals hier.
Voor de nieuwe testmethode verbonden de wetenschappers twee Crispr-eiwitten aan een gesplitst bioluminescent (oplichtend) eiwit, luciferase genaamd. ‘Dat luciferase wordt lichtgevend zodra die twee complementaire delen bij elkaar worden gebracht’, zegt biomedisch ingenieur Harm van der Veer van de TU Eindhoven, hoofdauteur van het wetenschappelijke artikel.
Als de Crispr-eiwitten een stukje virus-DNA herkennen en vastgrijpen, is daarmee de verbinding tussen de twee delen van het luciferase hersteld. Deze gaat dan blauw licht uitstralen – vergelijk het met het lampje dat gaat branden als je bij het spelletje Dokter Bibber de juiste verbinding maakt.
Het blauwe licht dat hierbij ontstaat is detecteerbaar met een digitale camera. De patiënt hoeft er dus niet voor naar een gespecialiseerd medisch centrum.
Vermenigvuldigen
Het probleem dat hiermee nog niet is opgelost, is dat virussen als SARS-CoV-2 vaak in extreem lage concentratie in het lichaam aanwezig zijn en dus nauwelijks zijn waar te nemen. Daarvoor moeten de enkele aanwezige stukjes genetisch materiaal van het virus steeds opnieuw worden gekopieerd en vermenigvuldigd, tot er wél voldoende is om meetbaar te zijn.
Bij PCR-testen is het juist dit dat de lange wachttijden veroorzaakt: voor het kopieerproces moeten DNA-strengen uit elkaar worden getrokken en nieuwe paren vormen, hetgeen gebeurt door het testmonster telkens opnieuw te verhitten en weer te laten afkoelen.
De Nederlandse onderzoekers gebruiken voor dit laatste een andere methode, die overigens al meer dan tien jaar bestaat, namelijk recombinase polymerase amplificatie (RPA). Dat komt kort gezegd neer op het toevoegen van een speciaal eiwit dat het DNA uit elkaar haalt. Daardoor is het steeds opnieuw verhitten niet meer nodig, en is de concentratie genetisch virusmateriaal binnen een half uur al hoog genoeg om te detecteren.
Van der Veer: ’RPA heeft ook een nadeel. Omdat het werkt bij een lage temperatuur van 40 graden Celsius, kan er ook aspecifieke DNA vermeerdering optreden in afwezigheid van het virale DNA/RNA in een monster. Er is dus een extreem nauwkeurige detectiemethode nodig, die het virus-DNA feilloos van dat aspecifieke DNA kan onderscheiden. Die hebben we met onze Crispr-methode gevonden, dus kunnen we nu die snellere methode gebruiken zonder aan betrouwbaarheid te verliezen.’
LUNAS
De nieuwe meetmethode heet LUNAS, een afkorting voor luminescent nucleid acid sensor. De volgende ziekten waarvoor LUNAS als opsporingsmethode geschikt zal worden gemaakt zijn onder andere soa’s (seksueel overdraagbare aandoeningen), met als doel deze makkelijk en snel bij de huisarts te kunnen detecteren.
Openingsbeeld: Depositphotos







