
Mineraal bindt CO2 bij waterstofproductie
Bij de productie van waterstof uit aardgas komt CO2 vrij. Dat broeikasgas kun je echter prima binden aan een vaste stof, zodat je het later onder de grond kunt stoppen of gebruiken als grondstof. Dat blijkt uit onderzoek van Kai Coenen aan de Technische Universiteit Eindhoven, waarop hij dinsdag 9 oktober promoveert.
Het maken van waterstof gebeurt nu nog veelal uit aardgas. Dat gas (methaan) gaat samen met stoom een zogeheten reformer in en wordt daarin omgezet in syngas, een mengsel van koolmonoxide en waterstof (zie de eerste reactie hieronder). In een tweede reactie gaat het koolmonoxide een reactie aan met water, waarbij kooldioxide en – nogmaals – waterstof ontstaat.
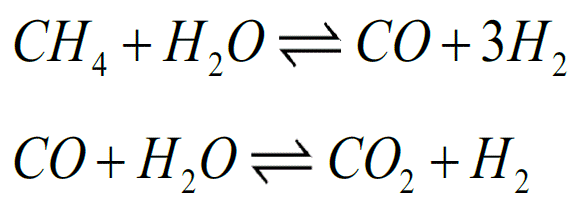
Omdat die tweede reactie een evenwichtsreactie is, kun je de opbrengst van het rechterdeel opvoeren door reactieproducten af te voeren. Concreter gezegd: als je CO2 ergens aan bindt, maak je ook meer waterstof. Hier richtte Kai Coenen zich op met zijn promotieonderzoek aan de TU Eindhoven.
Mengsel van metaaloxiden
Hij onderzocht vaste stoffen waar CO2-moleculen aan hechten. Uit die stoffen kun je het broeikasgas later in geconcentreerde vorm terugwinnen. Hij focuste vooral op zogeheten hydrotalciet, een mengsel van metaaloxiden zoals aluminiumoxide, magnesiumoxide en kaliumcarbonaat. ‘Die stof komt gewoon in de natuur voor, maar wij richtten ons op de kunstmatige vorm, omdat je dan de eigenschappen optimaal kunt instellen voor het zo goed mogelijk binden van CO2’, vertelt Coenen aan de telefoon vanuit Ludwigshafen, waar hij inmiddels werkt voor een Duitse chemiereus.
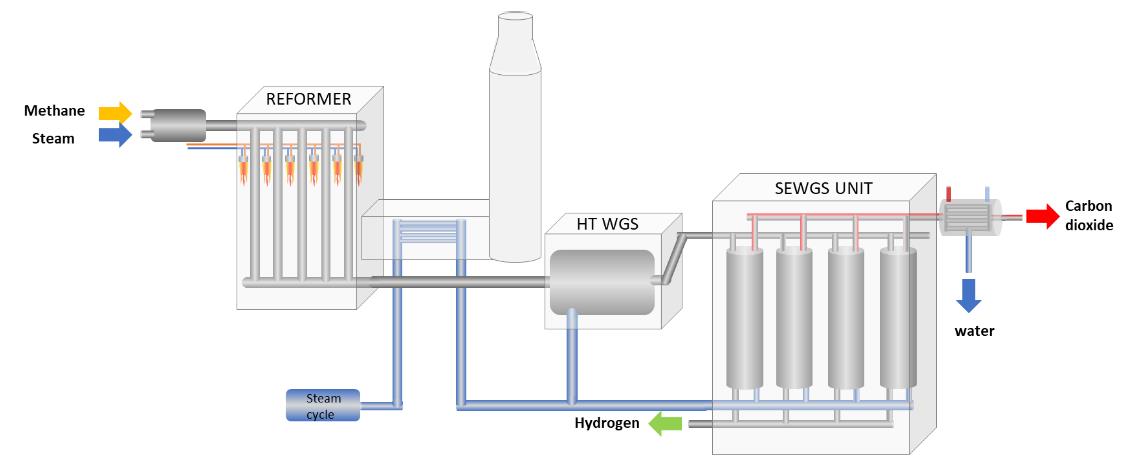
Het idee is om hydrotalciet in de vorm van geperste, poreuze korrels van 4,5 mm doorsnede in een kolom te stoppen (zoals in de figuur hierboven, de 'SEWGS-unit') en daar het syngas (CO en H2) doorheen te leiden. Het kooldioxide bindt zich dan aan de korrels, en het waterstof stroomt verder naar opslagtanks. (lees: ‘Nederland waterstofland’). Als de korrels verzadigd zijn, is het CO2 er weer uit te halen door er stoom langs te laten stromen.
Snelheden berekenen
Coenen experimenteerde met dit proces en ontdekte daarmee hoe snel het verloopt. Ook leerde hij veel over het verband tussen de vorm van het oppervlak van het hydrotalciet en het binden van CO2. Conclusie: het lostrekken van het CO2 is de belangrijkste stap om het gehele proces (van aardgas naar waterstof) een stuk efficiënter te maken. ‘Het was al bekend dat stoom sterker aan CO2 'trekt' dan stikstof dat doet, maar met mijn model kun je de snelheden berekenen.’
Geconcentreerde CO2-stroom
Hét voordeel van het CO2-bindende materiaal is dat je een geconcentreerde stroom CO2 overhoudt. Handig als je dat als nuttige grondstof voor een volgende processtap wil gebruiken (lees: 'Carbon-XPrize mikt op nuttige CO2-toepassingen'). En mocht de overheid ooit het afvangen van CO2 verplicht gaan stellen, dan is hydrotalciet ook een goede kandidaat.
Het promotiewerk van Coenen zit erop, maar zijn model kan dienen als opstapje naar een model dat de processtromen beschrijft. Daarmee kan bijvoorbeeld worden berekend hoeveel kolommen met hydrotalciet optimaal zijn in een fabriek. In Zweden draait momenteel de enige proeffabriek die hydrotalciet gebruikt. Hier werkt ook Energieonderzoek Centrum Nederland (ECN, onderdeel van TNO) aan mee.
Openingsfoto: stuk hydrotalciet van 8,4 cm lang, gevonden in Noorwegen. Bron: iRocks.com / CC-BY-SA-3.0. Overig beeldmateriaal Kai Coenen, PhD Thesis, 2018.






